Estructura Cristalina de Algunas Sustancias Covalentes
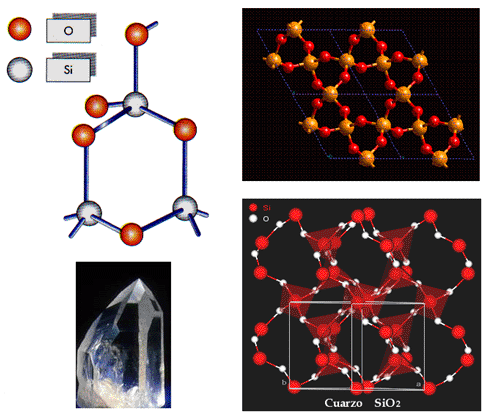
Cuarzo: El cuarzo es una estructura particular de cristalizar el dióxido de silicio. Cada átomo de Si se encuentra enlazado con 4 de O y a su vez cada O está unido a dos Si mediante enlaces covalentes polares, formando una red de gran número de átomos, (SiO2).
Carbono diamante: En el carbono diamante, los átomos de carbono se unen para formar un retículo cristalino de dimensiones infinitas, en la que cada uno de ellos se une a otros cuatro mediante enlaces covalentes puros formando estructuras tetraédricas. Esto explica su elevada dureza, su baja reactividad, su nula conductividad eléctrica y su casi infusibilidad.

Carbono grafito: Es otra estructura cristalina del carbono. Mientras que el carbono diamante es una red tridimensional, el grafito es un sólido con redes en forma de capa. Contiene agrupaciones de átomos de carbono unidos por enlaces covalentes puros, de dimensiones infinitas, pero en dos direcciones. De los cuatro electrones que tiene cada uno de los átomos de carbono, tres se utilizan para unirlo con un enlace covalente puro a otros tres en un mismo plano formando estructuras hexagonales de seis átomos, y el cuarto electrón está deslocalizado entre los planos tratando de unirlos. En virtud de esta estructura, el carbono grafito es conductor de la electricidad y del calor, carece de la dureza del diamante y se exfolia fácilmente, es decir, se puede laminar.

Mario Pedraza
Electrónica del Estado Sólido Sección 2

Carbono diamante: En el carbono diamante, los átomos de carbono se unen para formar un retículo cristalino de dimensiones infinitas, en la que cada uno de ellos se une a otros cuatro mediante enlaces covalentes puros formando estructuras tetraédricas. Esto explica su elevada dureza, su baja reactividad, su nula conductividad eléctrica y su casi infusibilidad.

Carbono grafito: Es otra estructura cristalina del carbono. Mientras que el carbono diamante es una red tridimensional, el grafito es un sólido con redes en forma de capa. Contiene agrupaciones de átomos de carbono unidos por enlaces covalentes puros, de dimensiones infinitas, pero en dos direcciones. De los cuatro electrones que tiene cada uno de los átomos de carbono, tres se utilizan para unirlo con un enlace covalente puro a otros tres en un mismo plano formando estructuras hexagonales de seis átomos, y el cuarto electrón está deslocalizado entre los planos tratando de unirlos. En virtud de esta estructura, el carbono grafito es conductor de la electricidad y del calor, carece de la dureza del diamante y se exfolia fácilmente, es decir, se puede laminar.

Fuente: http://www.iesrdelgado.org/tomasgomez/2%C2%BA%20Bachillerato/QUIMICA/enlace%20covalente/punto4c.htm
Mario Pedraza
Electrónica del Estado Sólido Sección 2

No hay comentarios:
Publicar un comentario